Žemesnėse klasėse susipažinote su medžiagų sandara ir pagrindinėmis jų klasėmis: oksidais, rūgštimis, bazėmis ir druskomis. Mokėtės rašyti junginių formules, oksidacijos-redukcijos ir mainų reakcijų lygtis. Chemijos mokslas neįsivaizduojamas be nuodugnesnio elementų ir jų junginių savybių pažinimo. Visa tai nagrinėsite šiame chemijos vadovėlyje. Pirmas skyrius skirtas metalams – didžiausiam cheminių elementų skaičiui.

Išnagrinėję šį skyrių, gebėsite:
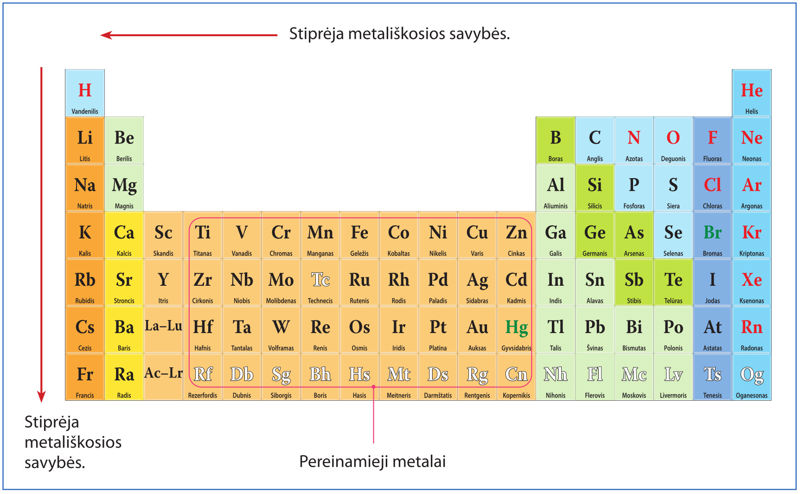
- apibūdinti metalų vietą periodinėje cheminių elementų sistemoje;
- apibūdinti bendrąsias metalų fizikines ir chemines savybes;
- apibūdinti elektrocheminę metalų įtampų eilę ir galvaninio elemento veikimo principą;
- grupuoti metalus į aktyvius ir mažiau aktyvius;
- išvardyti šarminius ir šarminių žemių metalus, apibūdinti bendrąsias jų savybes;
- pateikti amfoterinių metalų oksidų ir hidroksidų pavyzdžių, apibrėžti šių junginių bendrąsias savybes;
- apibūdinti metalų koroziją ir kovos su ja būdus;
- apibūdinti metalų rūdas ir svarbiausių metalų gavybos būdus;
- apskaičiuoti cheminės reakcijos išeigą.