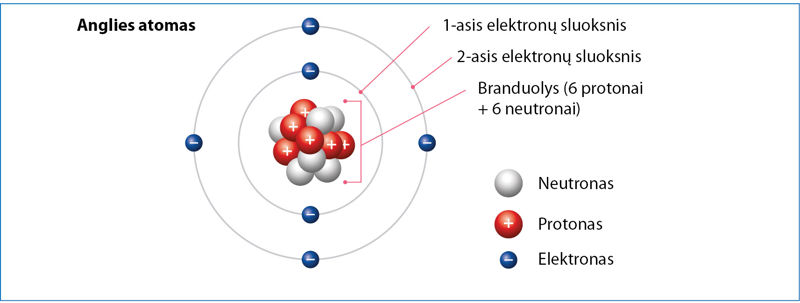
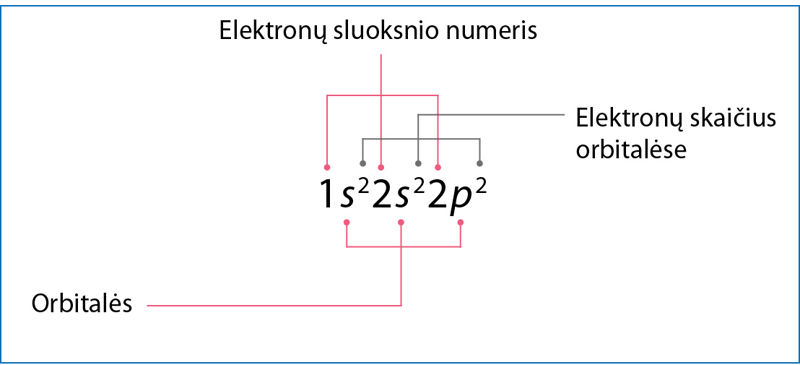
Prisiminkime anglies vietą periodinėje elementų sistemoje. Žinome, kad tai antrojo periodo elementas, kurio atomo branduolyje yra 6 protonai. Anglies atomas turi 6 elektronus, taigi jo išoriniame elektronų sluoksnyje yra 4 elektronai (1.1.1 pav.).
Remiantis šiuo vadinamuoju planetiniu modeliu elektronas įsivaizduojamas tik kaip dalelė. Tačiau toks atomo elektronų vaizdavimo būdas neatspindi tikrosios padėties. Elektronas – ne tik dalelė, bet ir banga. XX amžiaus fizikų ir matematikų tyrimai parodė, kad elektronų išsidėstymo paveikslas kur kas sudėtingesnis. Garsus austrų fizikas Ervinas Šrėdingeris (Erwin Schrödinger, 1887–1961) (1.1.2 pav.) įrodė, kad elektronų buvimą aplink branduolį galima aprašyti tam tikra matematine lygtimi, atsižvelgiant į dvejopą elektronų – kaip bangų ir dalelių – prigimtį. Ši lygtis buvo pavadinta jo vardu.
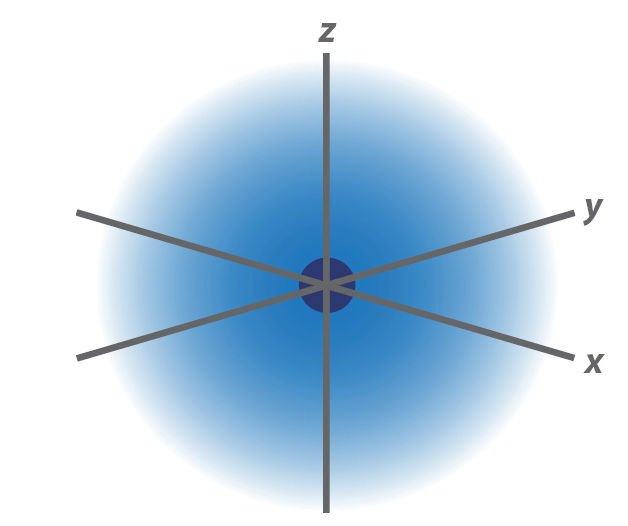
Buvo apskaičiuota, kad elektronus su tam tikra tikimybe galima aptikti apibrėžtose erdvėse – orbitalėse. Nepaisant šio termino sąskambio su sąvoka „orbita“, kuria apibrėžiama tiksli trajektorija, elektronai apie branduolį nesisuka kaip kokie palydovai tiksliai nustatytu taku. Tam tikroje erdvėje jie būna ir arčiau branduolio, ir šiek tiek toliau (1.1.3 pav.).
Orbitalė yra erdvės dalis, kurioje su tam tikra tikimybe (dažniausiai 95 proc.) galima aptikti elektroną.
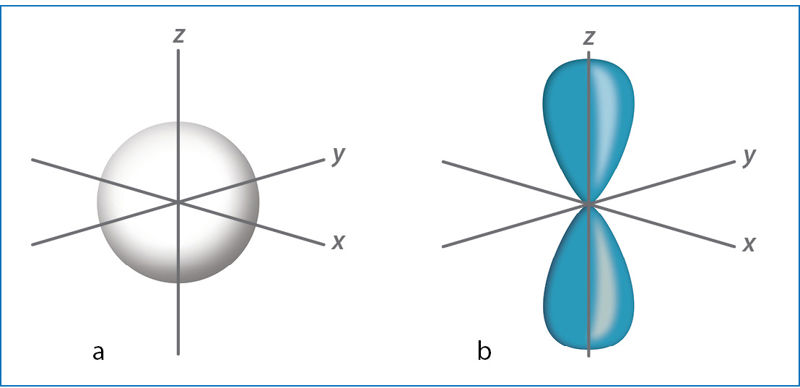
Pagal formą orbitalės skirstomos į tipus: s, p, d, f. Pavyzdžiui, s orbitalės forma panaši į rutulį (sferą), o p orbitalės – į aštuoniukę primenantį svarmenį (1.1.4 pav.).
Orbitalių skaičius ir tipas priklauso nuo atomo elektronų sluoksnio numerio. Vienoje orbitalėje gali būti ne daugiau kaip du elektronai.
Pavyzdžiui, vandenilis ir helis yra pirmojo periodo elementai, jie turi po vieną elektronų sluoksnį ir po vieną orbitalę. Pirmajame elektronų sluoksnyje gali būti tik viena s tipo orbitalė. Kitų elementų atomai, turintys daugiau elektronų sluoksnių, orbitalių turi daugiau. Šiuose tolesniuose elektronų sluoksniuose gali būti skirtingos energijos orbitalių – mažesnės energijos s orbitalių ir didesnės energijos p orbitalių. Antrojo periodo elementai (litis, berilis, boras, anglis, azotas, deguonis, fluoras ir neonas) pirmajame sluoksnyje turi s tipo orbitalę, o antrajame 4 orbitales – vieną s tipo ir tris p tipo. Trečiajame elektronų sluoksnyje gali būti net 9 orbitalės (1.1.1 lentelė).
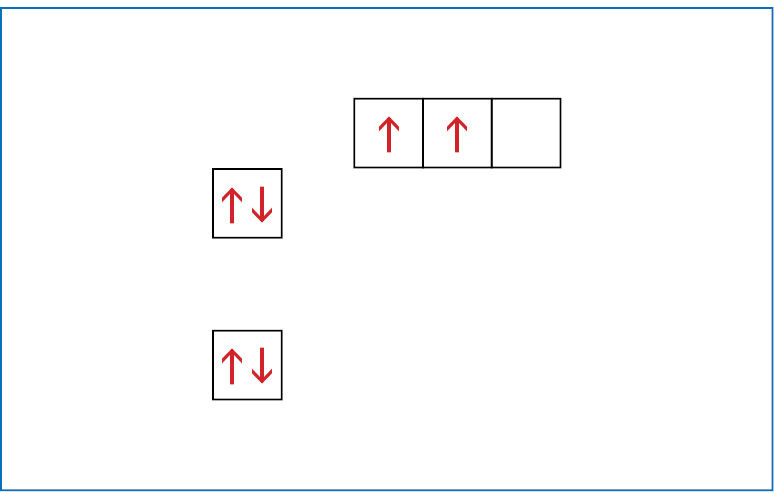
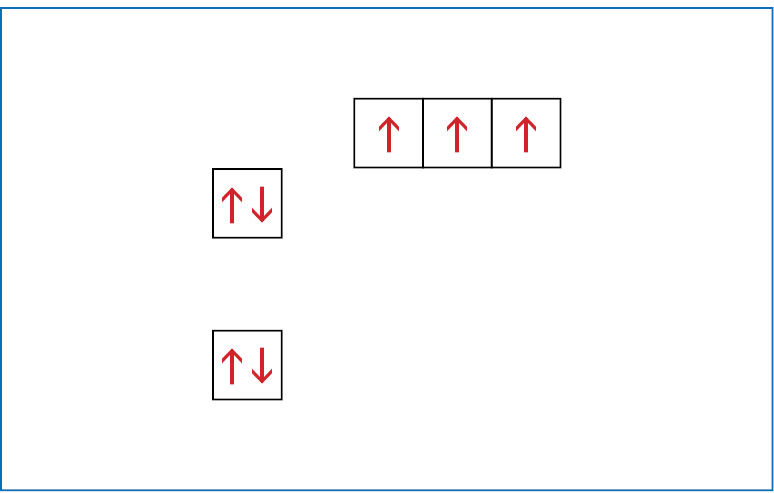
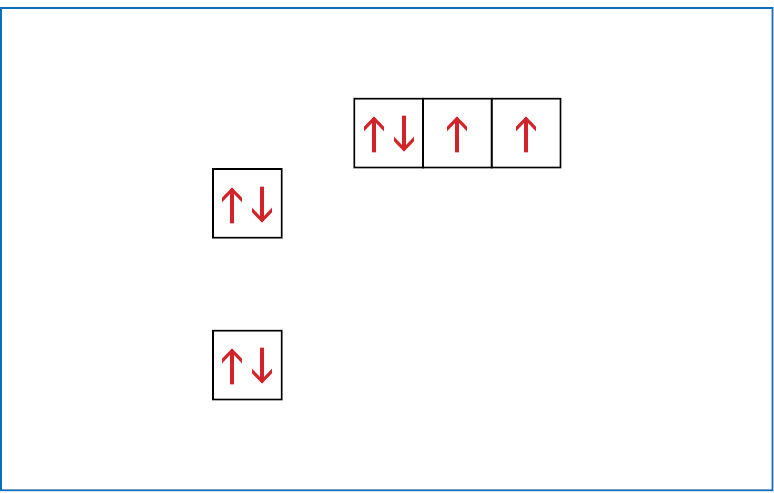
Kad nereikėtų kaskart piešti orbitalių, jas galima vaizduoti langeliais. Anglies atomo sandarą galima įsivaizduoti kaip namą, kurio pirmajame aukšte (pirmajame sluoksnyje) yra vienas butas – s orbitalė. Antrajame aukšte (antrajame sluoksnyje) yra net keturi butai – viena s ir trys p orbitalės. Kaip minėta, s tipo orbitalių energija mažesnė nei p orbitalių, todėl antrojo sluoksnio s orbitalės langelis vaizduojamas kiek žemiau nei p orbitalių langeliai. Supaprastinta anglies atomo elektroninės sandaros schema gali būti pavaizduota taip (1.1.5 pav.):
Tiek pat orbitalių – erdvių, kuriose galima aptikti elektronų, – turės visi antrojo periodo elementai, nuo ličio iki neono. Apie aukštesnių elektronų sluoksnių orbitales sužinosite kitoje klasėje.